Un exemple fondamental connu depuis bien longtemps montre que le destin de l’organisme hu-main dépend étroitement de sa colonisation bactérienne: les mitochondries, qui fournissent dans une certaine mesure de l’énergie à presque chaque cellule humaine, sont les restes d’organismes autonomes ressemblant à des bactéries qui ont fusionné avec les cellules humaines au cours de l’évolution. Une question se pose alors: quel est le rapport entre l’intestin et sa flore bactérienne et une maladie auto-immune qui frappe un tout autre organe tel que le système nerveux central? Il n’y a pas si longtemps, il a pu être démontré que la suppression des bactéries «naturelles» de l’intestin d’un modèle expérimental de la SEP pouvait juguler entièrement la maladie. Cela a donc permis de démontrer que les bactéries intestinales jouent non seulement un rôle central dans le bon fonctionnement du système immunitaire, mais aussi dans l’apparition d’une maladie auto-immune.
A présent, ce constat important ne peut pas être mis directement à profit à des fins thérapeu-tiques car un être humain ne pourrait survivre sans flore intestinale bactérienne. Des branches de la recherche de plus en plus variées se sont toutefois formées sur cette base. Elles cherchent actuellement à déterminer les bactéries correspondant à une flore «saine» et celles pouvant éventuellement être associées à des maladies telles que la SEP. C’est une discipline encore jeune qui a déjà à son actif des résultats initiaux sur les bactéries éventuellement liées à des maladies. Toutefois, nous sommes actuellement encore loin de comprendre les interactions complexes régnant au sein de l’ensemble des bactéries intestinales ou de ce que l’on appelle le microbiome intestinal. Compte tenu de l’estimation actuelle selon laquelle les bactéries seraient dix fois plus nombreuses que l’ensemble des cellules du corps humain, il est parfaitement compréhensible que de nombreuses questions concernant l’organisme sain ou l’organisme touché par une maladie auto-immune n’aient pas encore été résolues. Force est de constater que le régime alimentaire occidental largement répandu et composé essentiellement de glucides simples, de sucres et de graisses animales engendre une modification radicale du microbiome intestinal et en particulier une réduction de la diversité bactérienne.
Le rôle de l’alimentation dans le cas de la SEP
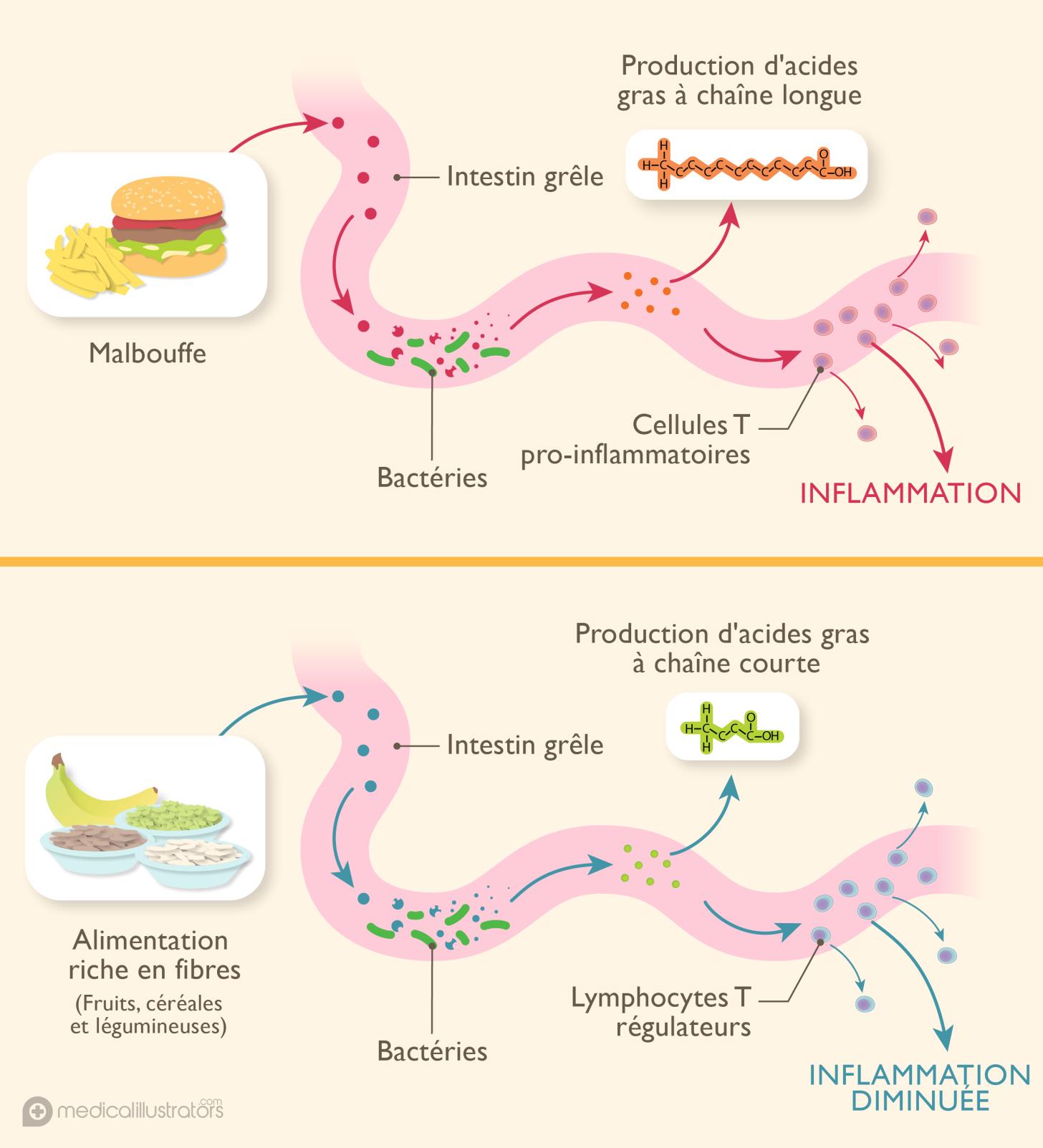
Les mécanismes permettant de comprendre le rôle d’un apport accru de sel dans l’apparition et la multiplication de foyers inflammatoires auto-immuns dans le contexte de la SEP ont récemment été identifiés. Parmi la multitude d’aliments absorbés, quels sont les autres éléments pouvant influencer positivement ou négativement la SEP? C’est une question que les patients SEP se posent souvent à eux-mêmes ainsi qu’à nous autres neurologues. Les premières études portant sur cette question remontent à l'après-guerre. L’observation selon laquelle il y avait moins de cas de SEP dans les régions côtières de Norvège qu’à l’intérieur du pays a donné naissance à une théorie postulant qu’une alimentation riche en graisse animale (intérieur du pays) pourrait favoriser l’apparition de la SEP, contrairement à une alimentation riche en poissons et en légumes. Par conséquent, le régime du Dr Swank, du nom de l’auteur de cette étude, consiste essentiellement à éviter les graisses animales. Ce régime connaît aujourd’hui un renouveau. A plusieurs reprises, d’autres études portant sur un éventuel effet positif des acides gras oméga 3 (des acides gras polyinsaturés à chaîne longue) n’ont pas pu démontrer d’effet thérapeutique dans le cas de la SEP. Dans le cadre d’un projet de recherche mené en collaboration avec des scientifiques de l’université d’Erlangen sans participation de l’industrie, nous avons étudié les propriétés des acides gras susceptibles d’avoir une influence sur le système immunitaire.
A cette fin, nous avons examiné l’effet direct d’acides gras de longueurs différentes (acides gras à chaîne courte, moyenne ou longue) sur les cellules immunitaires dans un milieu de culture ainsi que l’effet d’une prise orale, et donc du passage intestinal des acides gras, sur l’évolution de la maladie dans un modèle expérimental de la SEP appelé encéphalomyélite auto-immune expéri-mentale (EAE). Il est intéressant de noter qu’avec l’augmentation de leur longueur, notamment chez les acides laurique et palmitique de longueur moyenne et respectivement grande, les acides gras saturés conduisent à une génération et à une multiplication accrue de lymphocytes pro-inflammatoires dans la paroi intestinale et donc à une évolution plus aiguë de l’EAE. Au contraire, avec la réduction de la longueur de la chaîne, surtout démontrée dans le cas de l’acide propionique, les acides gras engendrent une augmentation des effectifs de lymphocytes régulateurs (la «police immunitaire») et entraînent une évolution plus bénigne de l’EAE en cas d’administration orale. Dans une étude de suivi menée à l’université de la Ruhr au sein de l’hôpital Saint-Joseph, nous examinons actuellement si ces résultats peuvent être confirmés sur l’homme avec l’utilisation d’un sel de l’acide propionique, le propionate de sodium, tout d’abord chez des sujets sains et ensuite chez des patients SEP.
En attendant, nous avons examiné plus de 80 patients atteints de SEP et nous publierons pro-chainement les résultats de l’étude. En tant qu’éléments essentiels de notre nourriture quoti-dienne, le sel et les acides gras peuvent avoir une influence considérable sur le système immuni-taire à travers l’intestin et éventuellement trouver une application adjuvante en combinaison avec des immunothérapies autorisées. Cette observation ne permet que de présumer des possibilités imprévues qui pourraient résulter d’un changement de régime alimentaire et de l’influence sur l’intestin. Elle justifie une fois pour toutes de poursuivre les recherches dans ce domaine dans le contexte de la SEP. Nous considérons qu’il est judicieux d’étudier des modulations et des compléments alimentaires particulièrement simples pour réguler «positivement» la flore intestinale en cas de SEP. Bien que des idées plus extrêmes (telles qu’un «transfert de selles de membres sains de la famille au patient atteint de SEP» et donc une modification du microbiome) soient envisageables en médecine moderne, elles ne devraient pas pour autant constituer notre objectif dans le cas des maladies auto-immunes. A notre avis, de telles méthodes simples peuvent être employées en synergie avec et en complément des immunothérapies bien établies et ne doivent en aucun cas les remplacer.
Auteur: Aiden Haghikia, Clinique neurologique de l’université de la Ruhr à Bochum
(Avec l’aimable autorisation de la section Rhénanie du Nord-Westphalie de la Société allemande de la sclérose en plaque DMSG)
Bibliographie
1. Haghikia A, Hohlfeld R, Gold R, Fugger L., Therapies for multiple sclerosis: translational achievements and outstanding needs. Trends Mol Med. Mai 2013; 19(5):309-319.
2. Hedstrom AK, Hillert J, Olsson T, Alfredsson L., Smoking and multiple sclerosis susceptibility. Eur J Epidemiol. Nov. 2013; 28(11):867-874.
3. Kleinewietfeld M, Manzel A, Titze J, et al., Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells. Nature. 25 avr. 2013; 496(7446):518-522.
4. Berer K, Mues M, Koutrolos M, et al., Commensal microbiota and myelin autoantigen cooper-ate to trigger autoimmune demyelination. Nature. 24 nov. 2011; 479(7374):538-541.
5. Jangi S, Gandhi R, Cox LM, et al., Alterations of the human gut microbiome in multiple sclero-sis. Nat Commun.2016;7:12015.
6. Sonnenburg JL, Backhed F., Diet-microbiota interactions as moderators of human metabolism. Nature. Juil. 7 2016;535(7610):56-64.
7. Swank RL, Lerstad O, Strom A, Backer J., Multiple sclerosis in rural Norway: its geographic and occupational incidence in relation to nutrition. N Engl J Med. 8 mai 1952;246(19):722-728.
8. Torkildsen O, Wergeland S, Bakke S, et al., Omega-3 fatty acid treatment in multiple sclerosis (OFAMS Study): a randomized, double-blind, placebo-controlled trial. Arch Neurol. Août 2012; 69(8):1044-1051.
9. Haghikia A, Jorg S, Durscha A, et al., Dietary Fatty Acids Directly Impact Central Nervous Sys-tem Autoimmunity via the Small Intestine. Immunity. 19 avr. 2016; 44(4):951-953.