Medikamente müssen qualitativ hochstehend, sicher und wirksam sein – dafür sorgt Swissmedic, das Schweizerische Heilmittelinstitut. Als nationale Zulassungs- und Kontrollbehörde für Medikamente und Medizinprodukte ist Swissmedic in drei zentralen Bereichen tätig: Bewilligungen, Marktüberwachung und Zulassung.
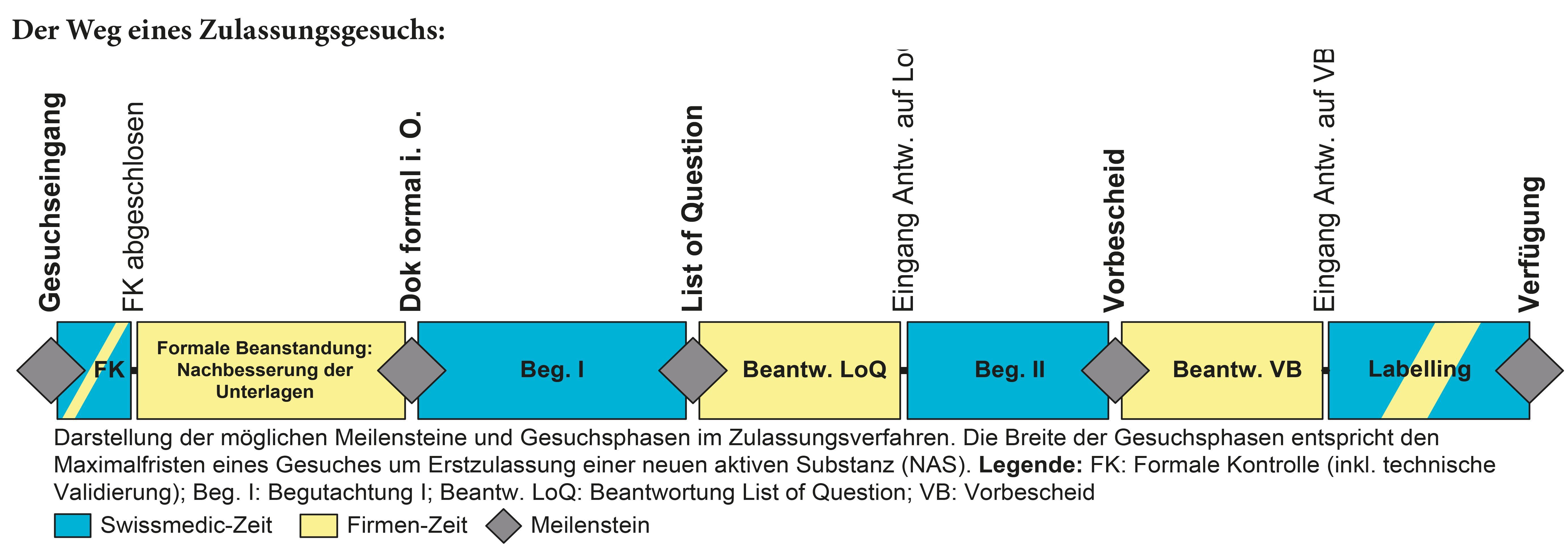
Arzneimittel dürfen in der Schweiz nur vertrieben werden, wenn sie von Swissmedic zugelassen sind. Zu den zulassungspflichtigen Arzneimitteln gehören synthetisch oder biotechnologisch hergestellte Humanarzneimittel, Arzneimittel der Komplementärmedizin und der Phytotherapie (Pflanzenheilkunde), Impfstoffe für den Menschen, Blutprodukte und Tierarzneimittel. Bei der Zulassung neuer Arzneimittel wendet Swissmedic die international geltenden Kriterien an. Die Prüfungen sind aufwändig und nehmen oft mehrere Monate in Anspruch. Swissmedic ist bestrebt, die Bearbeitungsfristen bei hoher Qualität der Begutachtung möglichst kurz zu halten, damit neue, wichtige Arzneimittel den Patientinnen und Patienten möglichst rasch zur Verfügung stehen. Im Rahmen des Zulassungsverfahrens beurteilt Swissmedic die Qualität, Sicherheit und Wirksamkeit der angemeldeten Arzneimittel anhand der begleitenden und umfassenden wissenschaftlichen Dokumentation. Diese Arbeit wird durch experimentelle Analysen der Laboratorien von Swissmedic gezielt unterstützt. Sind die Kriterien für eine Zulassung erfüllt, erlässt Swissmedic die entsprechende Verfügung, legt die Verkaufsart (Rezeptpflicht/ Abgabestellen) fest und genehmigt die Fach- und Patienteninformation.
Marktüberwachung Arzneimittel
Auch nach der Markteinführung unterstehen die Arzneimittel der behördlichen Kontrolle. Trotz weitreichenden Untersuchungen vor der Zulassung und strengen Zulassungskriterien können seltene Risiken erst nach der Markteinführung im Rahmen einer sehr breiten Anwendung und im alltäglichen Gebrauch erkannt werden. Swissmedic sammelt und bewertet Berichte über unerwünschte Wirkungen von Seiten der Fachpersonen (Ärzteschaft, Apothekerinnen und Apotheker sowie weitere), von pharmazeutischen Unternehmen sowie von Patientinnen und Patienten. Auch Qualitätsprobleme müssen gemeldet werden. Das Institut überprüft die eingehenden Meldungen sorgfältig und leitet bei neuen Risiken die erforderlichen Massnahmen ein. Dazu zählen: Vorsichtsmassnahmen bei der Anwendung, Einschränkung der Vertriebskanäle oder auch Rückruf eines Produkts aus dem Handel.
Ein beträchtliches Gesundheitsrisiko birgt der Internethandel: Das World Wide Web ermöglicht es, sich Arzneimittel aus aller Welt in die Schweiz liefern zu lassen. Viele der angebotenen Produkte sind jedoch qualitativ ungenügend, falsch beschriftet oder bewusst gefälscht. «Illegale Medikamente sind tödlich» warnte Swissmedic deshalb unlängst in einer gemeinsamen Kampagne mit der Pharmaindustrie und den Apotheken. Für die Werbung in der Presse, im Radio, am Fernsehen, im Kino oder im Internet gelten restriktive Vorschriften, deren Einhaltung von Swissmedic überwacht wird. Werbung für rezeptpflichtige Arzneimittel darf sich nicht an das Publikum, sondern ausschliesslich an Fachpersonen richten.
Betriebsbewilligungen
Wer Arzneimittel herstellt und vertreibt, benötigt eine Betriebsbewilligung. Wie bei der Zulassung gelten auch hier strenge Anforderungen und international gültige Regeln müssen eingehalten werden. Swissmedic erteilt die Betriebsbewilligung für die Herstellung, den Grosshandel sowie den Import und Export von Arzneimitteln. Basierend auf den eingereichten Unterlagen und einer Erstinspektion wird geprüft, ob ein Unternehmen die Voraussetzungen für eine Bewilligung erfüllt. Inspektionen sind ein wichtiges Instrument, um zu überprüfen, ob die behördlichen Anforderungen eingehalten werden.
Zulassung von MS-Medikamenten
Swissmedic zieht bei der Begutachtung der von der Firma eingereichten Gesuchsunterlagen die jeweils gültige Fassung internationaler Richtlinien (Guidelines) für die klinische Untersuchung von Arzneimitteln in der Behandlung der Multiplen Sklerose bei. Dabei werden die aktuell gültigen Diagnosekriterien, Definitionen und Klassifikationen der Multiplen Sklerose miteinbezogen. Die Entwicklung und die Begutachtung von Studien für die Behandlung einer Multiplen Sklerose ist eine grosse Herausforderung.
Zum einen werden verschiedene Stadien und Verläufe der Erkrankung unterschieden:
- klinisch isoliertes Syndrom (KIS)
- die schubförmige «relapsing-remitting» (RRMS) Verlaufsform
- die sekundär-progrediente (SPMS) Verlaufsform
- und die primär-progrediente (PPMS) Verlaufsform
Zum anderen verfolgt die Behandlung der Multiplen Sklerose verschiedene Therapieziele:
- Behandlung von Symptomen wie z. B. Fatigue, Spastizität, Harnblasenbeschwerden, etc.
- Behandlung des akuten Schubereignisses zur Verkürzung der Schubdauer und/oder der Schwere der Beschwerden und/oder Vermeiden bleibender Beschwerden
- Beeinflussung des natürlichen Verlaufs der Multiplen Sklerose mit Verhindern/Verzögern der Akkumulation von Behinderungen Verhindern/Beeinflussen von Schubereignissen
- Verbesserung chronischer Verlaufsformen
Dementsprechend unterscheiden sich der klinische Entwicklungsplan von potenziellen Arzneimitteln und das jeweilige klinische Studiendesign. Wichtig ist unter anderem, dass im Falle einer beabsichtigten chronischen (d. h. über Jahre andauernden) Behandlung zum Zeitpunkt der Zulassung Sicherheitsdaten von einer relevanten Anzahl an Patienten über mindestens zwei Jahre vorliegen. In den klinischen Studien sollte die Wirksamkeit eines potenziellen Arzneimittels zumindest gegenüber Placebo – also einem Scheinmedikament – gezeigt werden und zwar über mindestens ein Jahr, vorzugsweise jedoch über zwei Jahre. Sehr zu begrüssen und meistens auch aussagekräftiger sind Studien, die das neue potenzielle Arzneimittel im Vergleich zu einem in der jeweiligen Behandlungsstrategie der Multiplen Sklerose bereits etablierten Arzneimittel als aktive Kontrolle untersuchen.
Swiss medic
Als öffentlich-rechtliche Körperschaft des Bundes mit Sitz in Bern ist das Schweizerische Heilmittelinstitut Swissmedic in seiner Organisation und Betriebsführung selbständig und verfügt über ein eigenes Budget. Die Finanzierung erfolgt mehrheitlich über Gebühren und zu einem wesentlich kleineren Teil über Abgeltungen des Bundes. Swissmedic ist dem Eidgenössischen Departement des Innern angegliedert. Der Institutsrat vertritt als strategisches Organ die Interessen von Swissmedic gegenüber dem Departement und dem Bundesrat. Swissmedic beschäftigt rund 440 Mitarbeitende. Rechtliche Basis für die Tätigkeit von Swissmedic ist das Schweizerische Heilmittelgesetz.
Text: Daniel Lüthi, Swissmedic